Gyakorlat
Mikropipetta
A mikropipetta azon eszközök egyike, amivel az iskolában nem nagyon találkozhattatok, de az IBO-n biztos, hogy fogtok. Az alábbi rövid videóban nagyszerűen megmutatják a mikropipetta helyes használatát. Utána röviden le is írom a pipettázás menetét. Nem biztos, hogy ugyanilyen pipettát fogtok használni, de érdemi különbség nincs a pipetták között.
A pipettázás menete
- megfelelő térfogattartományú pipetta kiválasztása
- megfelelő térfogattartományú pipettahegy kiválasztása
- a kívánt mennyiség beállítása (figyeljetek az értékesjegyekre!)
- a pipettahegy felhelyezése (a hegyhez TILOS hozzáérni, erősen nyomjátok bele a pipettát a hegybe, hogy le ne essen!)
- nyomógomb benyomása első ütközésig
- a pipettahegy végének behelyezése az 1. mintába
- a nyomógomb ÓVATOS felengedése (ha hirtelen engeditek fel, az 1. minta feltapadhat a hegy belsejére, vagy akár a pipetta belsejébe is juthat)
- a pipettahegy végének belehelyezése a 2. mintába/tárolóba, vagy hozzáérintése a tároló falához (a felkeveredés, habosodás elkerülése végett)
- a nyomógomb benyomása második ütközésig
- a pipetta kivétele a 2. mintából
- a pipettahegy kilövése hulladéktárolóba a kilövő gomb megnyomásával
FONTOS!
- a pipettát lehetőség szerint függőlegesen, de semmiképpen se fejjel lefelé tartsátok!
- nem juthat folyadék a pipetta belselyébe, mert tönkreteszi!
- főleg nagyobb mennyiségeknél óvatosan engedjétek fel a nyomógombot
- minden pipettázáshoz külön hegyet használjatok, hacsak nem kaptok más utasítást, vagy nem vagytok biztosak benne, hogy csak egy anyaggal érintkezik a pipetta
- ha bármilyen módon beszennyeződik a hegy, használjatok másikat!
Gélelektroforézis
Ezzel a technikával szintén könnyen összefuthattok a gyakorlatokon. Az alábbi videón bemutatják a futtatócella használatát (mellesleg pont ilyen típust használnak a válogató döntőjén). Sajnos nem mutatják be viszont a gél kiöntését. Erről az egyszerű műveletről könnyen találhattok videót a neten, de amúgy sem valószínű, hogy feladat lesz. A videó alatt le is írom az előkészítés, futtatás, előhívás és kiértékelés menetét.
A gélelektroforézis menete
- a gél előkészítése (kivétele tárolóból, esetleg kiöntése)
- a futtatócella feltöltése pufferrel
- a gél behelyezése a futtatócellába (a zsebek a negatív pólus felé vannak)
- futtatni kívánt minták előkészítése (általában DNS, hasítóenzimek és festék összepipettázása eppendorf csövekben)
- a minták betöltése a gélzsebekbe
- a futtatócella tetejének felhelyezése
- a futtatási idő és feszültség beállítása
- a futtatás megkezdése
- megadott ideig a gél futtatása
- a futtatás leállítása
- a fedő levétele
- a gél kiemelése
- a gél előhívása (általában ultraibolyafényben lefényképezik)
FONTOS!
- vigyázzatok a gélre, nehogy eltörjön!
- jelöljétek meg az eppendorf csöveket, készítsetek tervet arról, hogy melyik zsebbe mi fog kerülni, nehogy később összekeverjétek!
- figyeljetek oda a futtatási irányra (a DNS mindig a pozitív pólus felé fut)!
- mivel hosszú az inkubációs idö, érdemes előre megtervezni a teendők sorrendjét (amíg fut a gél, tudtok csinálni más feladatot)!
- az előhívás általában közös eszközzel történik, minél gyorsabbak vagytok, annál kevesebbet kell majd várni!
A gélelektroforézis elmélete, kiértékelés
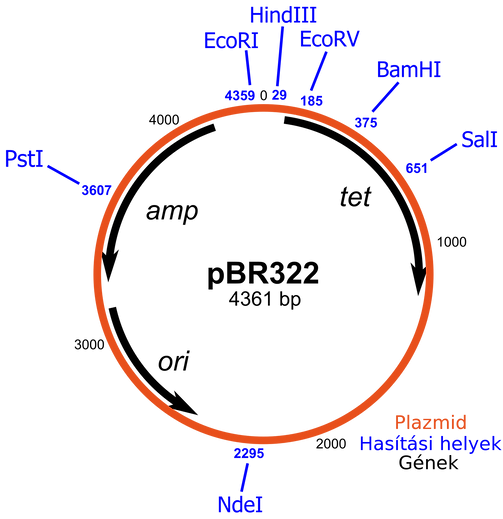 A gyakorlaton szinte biztos, hogy plazmidot fogtok hasítani valamilyen restrikciós endonukleázzal (egy ilyen hasítási térkép látható a jobb fenti képen). A vizsgálni kívánt szakaszokat PCR-ral
felszaporítjátok, majd festés után megfuttatjátok a gélen. A
gélelektroforézis működési elve, hogy a DNS szakaszok a pozitív pólus
felé vándorolnak az agaróz gélben, viszont mivel a rövidebb szakaszoknak
kisebb az ellenállásuk, ezért gyorsabban haladnak. Ez lehetővé teszi a
DNS szakaszok méret szerinti (mértékegysége: bp, azaz bázispár)
különválasztását. A gélen a vizsgált minták mellett egy ún. létrát is
futtatunk, ami ismert hosszúságú DNS szakaszokat tartalmaz, amihez
viszonyíthatjuk a többi szakasz hosszát.
A gyakorlaton szinte biztos, hogy plazmidot fogtok hasítani valamilyen restrikciós endonukleázzal (egy ilyen hasítási térkép látható a jobb fenti képen). A vizsgálni kívánt szakaszokat PCR-ral
felszaporítjátok, majd festés után megfuttatjátok a gélen. A
gélelektroforézis működési elve, hogy a DNS szakaszok a pozitív pólus
felé vándorolnak az agaróz gélben, viszont mivel a rövidebb szakaszoknak
kisebb az ellenállásuk, ezért gyorsabban haladnak. Ez lehetővé teszi a
DNS szakaszok méret szerinti (mértékegysége: bp, azaz bázispár)
különválasztását. A gélen a vizsgált minták mellett egy ún. létrát is
futtatunk, ami ismert hosszúságú DNS szakaszokat tartalmaz, amihez
viszonyíthatjuk a többi szakasz hosszát.
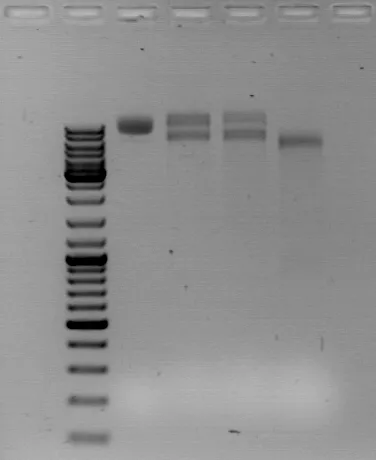
Az jobboldali képen egy megfuttatott gél látható. Fent látszanak a zsebek, baloldalt a létra, töle jobbra pedig a négy darab minta. A két szélső minta láthatóan egy DNS szkaszt taralmaz (a jobb szélső rövidebb, mint a bal szélső), míg a két középső azonos módon hasított két-két szakaszt. A létrához képest az összes szakasz elég hosszú.
Mivel a hasítóenzimek bázissorrend specifikusak, alkalmasak pontmutációk kimutatására. A feladatokban szerepelni szokott, hogy éppen mit kell vizsgálni, ennek megfelelöen egy plazmidtérképből ki kell tudni választani a megfelelő restrikciós enzimet, az előhívott gélből pedig le kell tudni olvasni a kapott szakaszok hosszát, amiből következtetést lehet levonni a jelenlévő mutációkra a megadott adatok alapján.
Spektrofotometria
FONTOS!
- a küvettákat mindig csak a durva felszínüknél szabad megérinteni!
- érdemes megszámozni a küvettákat
- ha microplate-tel dolgoztok, még jobban ügyeljetek arra, hogy megfelelö helyre mérjetek!
A spektrofotometriás mérés menete
- a minták elökészitése a küvettákban:
- bemérendő minta
- higító közeg
- megfelelő festék hozzáadása
- a minták összekeverése pipettával, vagy a küvetták föl-le fordításával (hőfóliát használva)
- a küvetták behelyezése a spektrofotométerbe
- spektrofotométer beállítása és mérések elvégzése
A spektrofotometriás mérés elmélete, kiértékelés

A spektrofotometriát arra szokták használni, hogy egy oldatban található vegyületcsoport (pl. DNS, fehérje), vagy más kolloid (pl. baktériumok) koncentrációját meghatározzák. Ehhez a vizsgált anyagot megfestik, majd megfelelő hullámhosszú fénnyel megvilágítják, és a visszanyert fény intenzitását mérik, amiből következtetni lehet a minta koncentrációjára. A spektrofotométerek általában az abszorbancia értékeket adják meg, amiből a Lambert-Beer-törvény segítségével (amit meg fognak adni, ha szükség lesz rá) ki lehet számolni az oldat koncentrációját. Az elméletről további infó itt.

A méréshez szükség van egy standard higítási sorra, aminek abszorbancia-koncentráció görbéje lesz a kalibrációs görbe. Az ismeretlen koncentrációjú minta abszorbanciáját felhasználva a görbére illesztve, vagy lineáris interpolációval megkapjuk a koncentrációt. Fontos, hogy a higítási sor első tagja ún. blank, ami a higító közegből áll, és abszorbancia értéke 0 kell, hogy legyen. Ha nem annyi, akkor az adott értéket az összes mérési eredményből kivonva kapjuk meg a korrigált értékeket.