Elmélet
Ezen az oldalon sok hasznos leírást, forrást, példát, módszert találhatsz, amik elsősorban az elméleti tesztnél lesznek segítségedre, de a gyakorlaton is hasznukat veheted.
Számolás
Ezen a linken elérhető a számolási követelmények teljes listája. Alább megtalálod a felsorolás elemeit különböző mértékben kifejtve.
pH számítás
pH-ból gyenge sav/bázis koncentrációja és vissza
Egy gyenge sav vagy bázis koncentrációjának kiszámítása a pH érték és az adott sav vagy bázis disszociációs állandójának (Ka vagy Kb) ismeretében történhet. Egy gyenge sav esetén a koncentráció a következő képlettel számítható ki: [A-] = √(Ka x [HA] / [H+]), ahol [A-] a gyenge sav konjugált bázisának a koncentrációja, [HA] a gyenge sav koncentrációja, és [H+] a hidrogénionok koncentrációja a oldatban (amit a pH értékből határozunk meg). Hasonlóan, egy gyenge bázis esetén a konjugált sav koncentrációja számítható ki a következő képlettel: [BH+] = √(Kb x [B] / [OH-]), ahol [BH+] a gyenge bázis konjugált savának koncentrációja, [B] a gyenge bázis koncentrációja, és [OH-] a hidroxidionok koncentrációja a oldatban (amit a pH értékből határozunk meg). A koncentrációk és a disszociációs állandók ismeretében a Henderson-Hasselbalch egyenletet használhatjuk a gyenge savak és bázisok pH értékének kiszámítására: pH = pKa + log([A-]/[HA]) a gyenge savaknál, illetve pH = pKb + log([BH+]/[B]) a gyenge bázisoknál.
Az ilyen, és ehhez hasonló kémiai számolások gyakorlásához Villányi Attila: Ötösöm lesz kémiából című feladatgyűjteményében találhatók hasznos feladatok. Fontos fogalmak: pH, K (egyensúlyi állandó).
pK értékek használata és értelmezése
A pK érték egy sav vagy bázis erejét méri, és az adott anyag savdisszociációs állandójának (Ka) vagy bázisdiszociációs állandójának (Kb) negatív logaritmusa, attól függően, hogy milyen típusú anyagról van szó. A pK érték egy módszer arra, hogy kifejezzük az anyag relatív savasságát vagy lúgosságát. Az alacsonyabb pK értékek erősebb savakra utalnak, míg a magasabb pK értékek gyengébb savakra. Hasonlóan, bázisok esetén a magasabb pK értékek erősebb bázisokat jelölnek, míg az alacsonyabb pK értékek gyengébb bázisokat.
Pufferek pH-ja (Henderson-Hasselbach egyenlet)
A pufferrendszerek pH-jának kiszámításához is a fentebb említett Henderson-Hasselbach egyenlet használható.
Titrálási görbék (pl. aminosavak titrálási görbéje)
A titrálás egy mennyiségi analitikai eljárás. Röviden egy ismert koncentrációjú oldat ismert mennyiségét reagáltatjuk ismeretlen koncentrációjú mintával, valamilyen jellegzetes változást várva. Ebből a reakció anyagmennyiségi arányainak ismeretében ki lehet számolni a másik oldat koncentrációját.
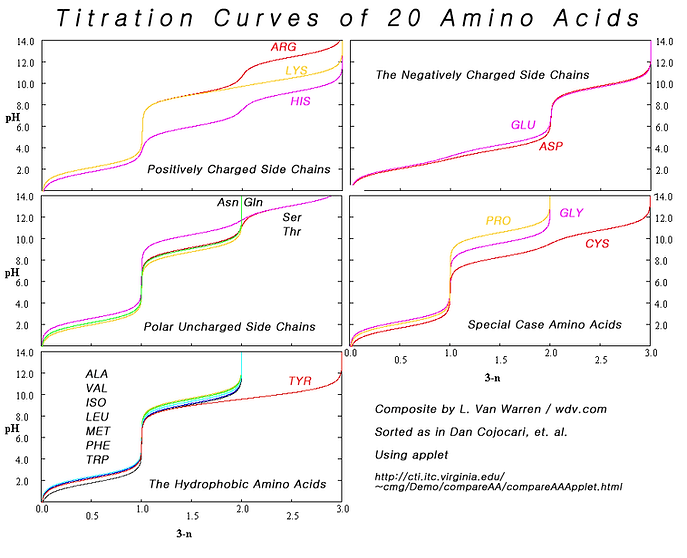
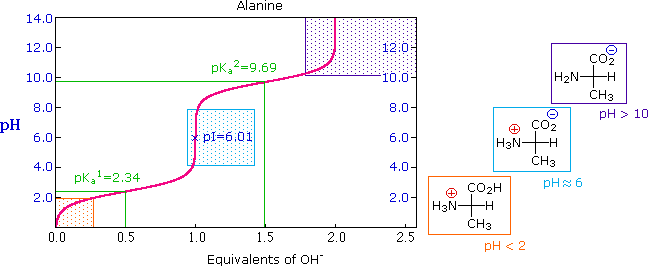
A titrálási görbéket úgy kapjuk, hogy miközben adagoljuk az egyik oldatot a másik oldatba, folyamatosan mérjük a pH-t, és ábrázoljuk a hozzáadott térfogat függvényében. Aminosavaknál ez azért különösen érdekes, mert ha savas közegben tartjuk őket, akkor lúgos titrálással mindig több proton is disszociál róluk (többek között az oldallánc függvényében) és így megkapjuk az aminosavunkra jellegzetes titrálási görbét (lásd alább). A titrálási görbéből pedig két fontos adat olvasható le: a pKa értékek (a savi disszociációs állandó, avagy Ka minusz 10 alapú logaritmusa) és az aminosav izoelektromos pontja, avagy pI (jelölve a jobboldali, lentebbi képen), amiről később még lesz szó.
Abszorpció és transzmittancia
Abszorpció számítása transzmittancia értékekből és vissza
Itt leggygakrabban a Lambert-Beer-törvényt kell használni, amely leírja a fény abszorpcióját, amikor az áthalad egy olyan oldaton, amely tartalmaz egy abszorbáló anyagot. Az egyenlet összefüggést állít fel a felszívódott fény intenzitása és az abszorbáló anyag koncentrációja, a fény útjának hossza az oldaton keresztül és egy állandó, az ún. moláris abszorpciós együttható között, ami az anyag adott hullámhosszán való fényelnyelő képességét méri. Az egyenlet így írható fel: A = εcl, ahol A az abszorbancia, ε a moláris abszorpciós együttható, c az abszorbáló anyag koncentrációja, és l a fény útja az oldaton keresztül. A Lambert-Beer egyenletet széles körben alkalmazzák a kémia és a biokémia területén a fényt elnyelő anyagok, mint például a kromofórok, pigmentek és biomolekulák, mint a fehérjék és nukleinsavak, kvantitatív elemzésére.
A spektrofotometria áttekintéséhez ajánlom ezt a rövid jegyzetet, ami bár gyakorlati jellegű, de hasznos az elmélet megértéséhez.
Kalibrációs görbe készítése és kalibrációs görbe alapján koncentráció-meghatározás
Ezen a területen három fő eset lehetséges:
-
Lineáris függvényt kell ábrázolni (egyenes vonal, ami a legjobban reprezentálja az adatpontokat), és ebből extrapoláltok/interpoláltok. Ez a legegyszerűbb: csak leolvassátok a grafikonról az adatot, vagy felírjátok az egyenes egyenletét.
-
Görbét kell ábrázolni (itt fontos, hogy ívet kell rajzolni), és arról nagyjából leolvasni a keresett értéket.
-
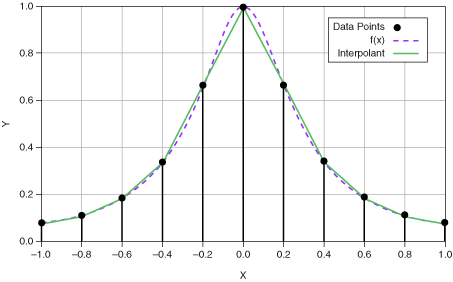
Görbét rajzoltok, és a feladat része, hogy lineáris interpolációval számoljátok ki a megfelelő értéket. Ez mindössze annyit jelent, hogy a keresendő érték közvetlen, ismert szomszédjai között lineáris összefüggést feltételezünk (alábbi kép).
A Biuret- és a Folin-Ciocolteau reagensek működési elve
Ezek a technikák a fehérjekoncentráció függvényében színezik meg az oldatokat, ami alkalmassá teszi őket spektrofotometriás mérésre. Működésükről annyit elég tudni, hogy a Biuret a peptidkötést lila színnel jelzi, a Folin-Ciocolteau alapvetően a fenolcsoportot (általában aminosavakban) mutatja ki kék színnel (alábbi képen egy tirozin higítási sor küvettákban).

Baktérium sejtszám meghatározása OD-értékek figyelembevételével
Az OD optical density-t jelent, ami megfelel a spektorofotometriából ismert abszorbancia értéknek. Ezt az értéket (gyakorlatilag egy kolloid oldat fényáteresztőképességét) könnyű műszeresen mérni, és jól jellemzi a kolloid koncentrációját (tehát alkalmas baktérium sejtszám meghatározásra). Ez a módszer az élő és elhalt baktériumokat is méri!
DNS-koncentráció meghatározás OD-értékek segítségével
Ugyanaz a sztori, csak DNS-sel.
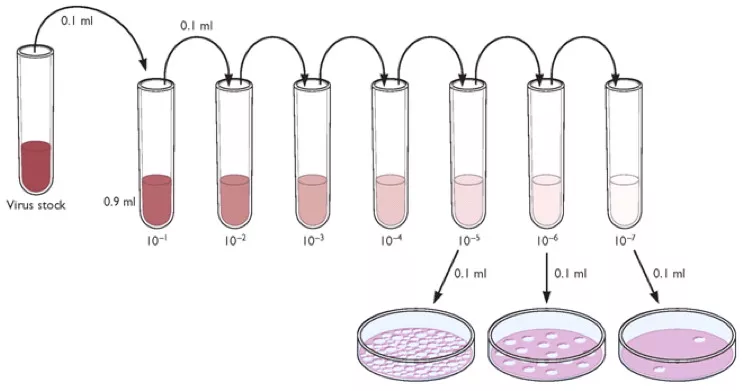
Baktérium/baktriofág telepszám meghatározás
CFU és PFU-értékek:
Colony Forming Unit és Plack Forming Unit. A CFU esetében az életképes baktériumszámot határozzuk meg, míg a PFU esetében a fertőzőképes bakteriofág számot. Azt feltételezzük, hogy megfelelő higítás mellett minden telep vagy fágok esetében plakk egy darab baktériumból vagy vírusból keletkezik. Túl nagy higítás esetén kevés telep/plakk fog keletkezni, amiből nem lehet elég pontosan következtetni a törzsoldat koncentrációjára (alábbi képen bakteriofág higítási sor, és ennek függvényében a szélesztés eredménye).
Kromatogram elemzése
A kromatográfia egy széles körben használt analitikai technika, amely kémiai és fizikai tulajdonságaik alapján szétválasztja és azonosítja az elegyek összetevőit.
Kromatogram részei
A kromatogram a detektor válaszának az idő függvényében történő ábrázolása. Az alapvonal a detektor válaszát jelenti, amikor nincs minta jelen, míg a csúcsok az egyes összetevőknek felelnek meg.

Retenciós faktor (távolság/idő)
A retenciós faktor azt jelzi, hogy adott komponensnek mekkora az átlagos sebessége a futtatás során. Ez azonos kísérleti körülmények esetén jellemző a komponensre.
Görbe alatti terület
Az egyes görbék alatti területet gyakran használják a komponensek mennyiségének kiszámítására. A csúcsok alatti területet egymással összehasonlítva kiszámítható az egyes komponensek relatív koncentrációja.

